Aspectos gerais da resposta imune contra nanocarreadores
A resposta imune contra os nanocarreadores, ocorre de modo similar aos microrganismos, incluindo vírus e bactérias. Como é de se esperar, a complexidade dessa resposta é elevada e dependente de diversos fatores.
A resposta imune se inicia imediatamente após a transposição de barreiras físicas e químicas, como:
- a pele;
- as mucosas;
- a lágrima;
- o suco gástrico;
- as secreções em geral.
Essas barreiras são um desafio para nanocarreadores cuja via de administração é intranasal, intrapulmonar, oral, dentre outras. As formulações para via intravenosa são uma exceção a essa regra, pois atingem diretamente a corrente sanguínea.
Uma vez no organismo – seja na pele, nos pulmões, no sangue ou outros órgãos e tecidos – os nanocarreadores são reconhecidos pelas proteínas e células do sistema imune. Um conjunto de proteínas, incluindo aquelas da cascata do complemento, se aderem à superfície dos nanocarreadores formando uma cobertura chamada coroa proteica.
A cascata do complemento compreende aproximadamente 50 proteínas presentes nos fluidos biológicos ou inseridas nas células, cujas funções são:
- marcar os microrganismos invasores para reconhecimento pelas células imunes – atividade mais conhecida como opsonização;
- atrair células do sistema imune (como granulócitos, monócitos, macrófagos, células dendríticas, células T, células Natural Killer) para o local da infecção – ação também conhecida como quimiotaxia;
- lisar microorganismos pela formação de um complexo terminal do complemento.
Tanto a coroa proteica, quanto o sistema imune, influenciam o destino biológico dos nanocarreadores.
Nanocarreadores para administração intravenosa
Os nanocarreadores podem ser projetados visando estimular ou suprimir uma resposta imune. Estimular o sistema imune é útil no desenvolvimento de vacinas, enquanto suprimi-lo é crucial no tratamento de doenças inflamatórias e autoimunes [1].
Existe ainda uma terceira situação: nanocarreadores planejados para “fugir” do sistema imune e permanecerem em circulação por tempo prolongado. Essa longa circulação, em geral, favorece o aumento da exposição do alvo ao fármaco quando comparado com o fármaco livre. No entanto, nem sempre está atrelada à superior eficácia do nanomedicamento. Em outros casos, a rápida eliminação é conveniente, como por exemplo no desenvolvimento de nanocarreadores para desintoxicação de pacientes.
Independente do objetivo do nanocarreador, conhecer a resposta imune que ele desperta pode ser um grande aliado no desenvolvimento de novos nanomedicamentos.
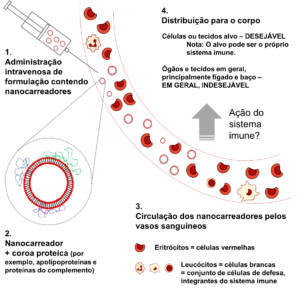
O destino de nanocarreadores após entrada pela corrente sanguínea e interação com o sistema imune. Ao atingir a corrente sanguínea (1), os nanocarreadores são cobertos por proteínas (representadas em azul, verde e roxo) (2). O nanocarreadores circulam pelos vasos sanguíneos (3), se distribuindo pelo corpo (4) até sua eliminação. O tempo de circulação e a distribuição dos nanocarreadores dependem de diversos fatores, sendo um deles a resposta imune.
Destino biológico das nanocarreadores é definido pelo sistema complemento?
Acredita-se que as proteínas do complemento estejam intimamente relacionadas ao tempo de circulação de nanocarreadores. Alguns autores também relacionam o complemento às reações de hipersensibilidade observadas na clínica. O efeito na farmacocinética e biodistribuição, entretanto, continua sendo debatido.
- Nanopartículas poliméricas
O trabalho intitulado “Mechanistic understanding of in vivo protein corona formation on polymeric nanoparticles and impact on pharmacokinetics” [2], mostra por estudos in vivo que a cascata do complemento não é suficiente para explicar o comportamento biológico de nanopartículas poliméricas. As apolipoproteínas J, por outro lado, têm efeito protetor, desacelerando a eliminação das nanopartículas [2]. Esse trabalho, publicado em 2017 pelo Prof. Dr. Nicolas Betrand (ULaval, Canadá), pela Profa. Dra. Eliana Martins Lima (UFG) e demais colaboradores, levantou novos questionamentos, dentre os quais destaco: qual o efeito da cascata do complemento em lipossomas?
- Lipossomas
Os lipossomas são nanocarreadores com amplo uso na área farmacêutica pela sua composição biocompatível e biodegradável, dentre outras vantagens. Eles são formados por uma bicamada de fosfolipídeos, uma estrutura semelhante à célula animal. A superfície das lipossomas pode ser modificada, por exemplo, pelo polímero polietilenoglicol (PEG). Lipossomas cobertos por PEG são também conhecidos como PEGuilados, enquanto aqueles sem a cobertura são chamamos não-PEGuilados.
Existem diversos nanomedicamentos a base de lipossomas aprovados pelo FDA (Food and Drug Administration) e EMA (European Medicine Agency). Três grandes sucessos, a título ilustrativo, são:
- Doxil®/Caelyx®, uma fomulação contendo lipossomas PEGuilados encapsulando o fármaco doxorubicina;
- Vyxeos®, uma formulação contendo lipossomas não-PEGuilados encapsulando os fármacos daunorubicina e citarabina;
- Myocet®, uma formulação contendo lipossomas não-PEGuilados encapsulando o fármaco doxorubicina.
Os lipossomas, tanto os PEGuilados quanto os não-PEGuilados,
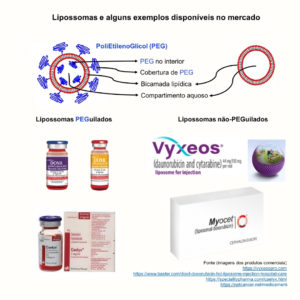
Alguns exemlos de nanomedicamentos comerciais injetáveis a base de lipossomas.
são fracos ativadores da cascata do complemento in vitro, como mostrado em “Role of complement cascade in the biological fate of liposomes in rodents” [3]. Esse trabalho nos informa sobre a interação nano-bio, sem vislumbrar a aplicação dos lipossomas em estudo. Foram empregados lipossomas vazios, com perfil de circulação diferentes (rápido e lento). A priori esses lipossomas são aplicáveis, mediante as modificações pertinentes, para uma finalidade imunoestimulatória ou imunossupressora.
Nesse trabalho foi mostrado que a cascata do complemento não induz a liberação de conteúdo dos lipossomas quando incubados em soro de camundongo, rato ou humano [3]. De modo semelhante ao observado com nanopartículas no estudo anterior [2], o impacto do complemento na eliminação de lipossomas é sutil, sendo perceptível apenas na fase tardia da circulação dos lipossomas quando baixas doses foram administradas por via intravenosa em camundongos e ratos [3]. Nessas condições, as proteínas do complemento conduziram os lipossomas para distribuição para as células B esplênicas [3]. Outro resultado interessante aponta que a composição celular do baço varia conforme a condição imune do camundongo: com ou sem níveis normais de proteínas do complemento [3].
Perspectivas
Em suma, os efeitos da interação do sistema imune com nanocarreadores depende de vários fatores, como as características do nanocarreador (tipo e composição), da via de administração (incluindo dose e sistema posológico) e da condição imune do animal (no nosso exemplo, os níveis séricos das proteínas do complemento). Estamos no caminho para dimensionar os efeitos das proteínas da coroa proteica e do sistema imune no destino biológico de nanocarreadores. Porém, ainda aquém de um profundo entendimento desse dinâmico processo. A maior compreensão nos tornará mais assertivos no desenvolvimento de novos nanomedicamentos.
Referências Bibliográficas
1 Zolnik BS, Gonzalez-Fernandez A, Sadrieh N, Dobrovolskaia MA. Minireview: Nanoparticles and the immune system. Endocrinology 2010; 151: 458-65.
2 Bertrand N, Grenier P, Mahmoudi M, Lima EM, Appel EA, Dormont F, et al. Mechanistic understanding of in vivo protein corona formation on polymeric nanoparticles and impact on pharmacokinetics. Nature Communications 2017; 8: 1-8.
3 Viana IMO, Grenier P, Lima EM, Bertrand N. Role of the complement cascade on the biological fate of liposomes in rodents. Nanoscale 2020; 12: 18875-84.
Escrito por Iara Maíra de Oliveira Viana, doutora em nanotecnologia farmacêutica pela UFG.
